科学家研发出新型液体口服胶囊:替代注射的新选择!

生物大分子药物是重要的药物发展方向之一。在 2020 年全球药品销售额 TOP20 榜单中,生物大分子一骑绝尘,独占 12 席。
胰岛素、抗体、蛋白等大分子药物在胃肠道部位常常会被蛋白酶水解,因此大分子药物的给药方式主要以注射为主。而凭借着用药简单、化学稳定性更强、也不会产生废弃针头等优势,口服制剂也被视为大分子药物递送的 “圣杯”。以胰岛素为例,自 1922 年人类首次注射胰岛素治疗糖尿病以来,研究人员从未停止过探索口服胰岛素。
Robert Langer 实验室就是开发口服大分子药物递送系统诸多团队中典型的代表。Robert Langer 是 MIT David H. Koch 学院教授(这是 MIT 教授能够获得的最高荣誉),他在药物递送系统及控制释放技术开拓了全新的领域,被称为 “药物递送之父”。自 1974 年,他专注于研发如何用聚合物等材料递送像多肽、胰岛素、蛋白质、RNA、DNA 等大分子,一直在尝试创建各种递送工具并推进落地转化。
2015 年,Robert Langer 课题组得到了胰岛素巨头诺和诺德的资金支持,与布莱根妇女医院和诺和诺德的科学家共同尝试开发口服胰岛素等大分子药物递送平台。
日前,他们在 Nature 上发表了大分子药物递送系统技术的最新成果 —— 液体药物自定向递送系统(liquid self-orienting millimeter-scale applicator,L-SOMA)技术。MIT 机械工程助理教授兼布莱根妇女医院胃肠病学家 Giovanni Traverso 和诺和诺德副总裁 Ulrik Rahbek 是该论文的通讯作者。
与他们此前开发的胶囊相比,本次研究成果的创新之处在于可以实现液体大分子药物口服给药,载药量实现了数量级提升,现已在临床前试验中递送了阿达木单抗、GLP-1 类似物、重组人胰岛素和肾上腺素四种生物大分子,并且达到临床治疗剂量。
在这项研究中,研究人员证明,这种胶囊可以口服单抗或其他需要注射给药的蛋白质药物,用于治疗癌症、类风湿性关节炎以及克罗恩病。

(来源:Nature Biotechnology)
“虽然现在该系统还处于早期研究阶段,但我们相信该系统有可能改变多个领域的治疗方案。” Giovanni Traverso 说。
“针对该技术的研究和开发意味着,几种目前只能通过肠胃外注射给药的药物将来可能实现口服给药,我们的目标是尽快让该技术进入临床试验。”Ulrik Rahbek 说。
装载液体药物,一次可递送 4 毫克
早在 2019 年 2 月,Robert Langer 课题组与诺和诺德科学家们以 “豹龟” 为灵感,开发了一种可以口服大分子药物的特殊胶囊 ——self-orienting millimeter-scale applicator(SOMA),只有蓝莓大小。患者口服后,胶囊会在胃内壁上 “打一针”,然后递送胰岛素或者其他不能口服的生物制剂。
该胶囊的针头由压缩胰岛素制成,患者吞下携带药物的胶囊后,针头会插到胃壁中,然后胰岛素就会以可控速率释放。在研究中,所有胰岛素完全释放到血液中大约需要一个小时,一次最多可注射 300 微克的胰岛素。
(来源:MIT)
同年 10 月,该团队又尝试开发了一种可以把包含的药物递送到小肠壁的胶囊,这是口服胰岛素领域的又一项突破。与在胃中不同,他们设计出了一种新型胶囊,口服后,胶囊能在小肠中安全有效释放胰岛素。在猪中的测试结果表明,该胶囊有效释放胰岛素后可以立即降低血糖。
这种胶囊以 “豹龟” 为灵感,豹龟拥有又高又陡的龟壳,每次仰面朝天时也能够自己翻过身来。由于设计灵感参考了豹龟,这种胶囊也有一个高且陡峭的圆顶,类似于豹龟的龟壳,因此,无论胶囊以哪种形式进入胃或者其他部位,它都能够自己调整方向,把针头对准胃壁或者小肠壁。

此前的研究已经在大鼠和猪上进行了验证,研究证明该口服胶囊能够达到与皮下注射胰岛素相同的效果,同时没有什么副作用。
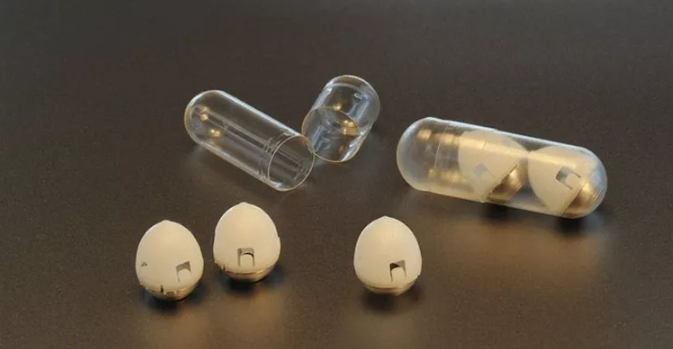
在最新研究中,Robert Langer 和合作者升级了这种特殊的胶囊,开发出了一种新型药物胶囊技术 ——L-SOMA,这是一种自注射胶囊。新升级的胶囊可以递送需要更快吸收或者难以配制为固体的液体药物,而此前的 SOMA 只能递送固体药物,不适用于液体药物。
与固体药物相比,液体药物进入血液的速度更快,对于治疗过敏反应的胰岛素和肾上腺素等药物十分关键。
升级版的新胶囊与之前的胶囊外形相同,但重新设计了胶囊内部,能够递送液体药物的剂量更大,大约可达到 4 毫克。而此前 SOMA 的递送量为 300 微克,新胶囊的递送量约为 SOMA 胶囊的 13 倍。在服药 30 分钟后,可以达到最大血药浓度,同时绝对生物利用度达到 80%,通常认为静脉给药制剂的生物利用度为 100%。
研究人员称,我们认识到液体药物更容易分布在胃的粘膜下平面内,与固体剂型相比,可以容纳更大的剂量。此外,与固体制剂相比,制剂与组织间相互作用的表面积增加,可以加速药物的药代动力学和药效学。
新型胶囊由液体药物、注射针头和能把液体挤出胶囊的柱塞。针头和柱塞由固体糖制成的颗粒固定。当胶囊进入胃部潮湿的环境中,颗粒开始溶解,将针头插进胃壁中,同时柱塞把液体药物挤进血液中。待液体药物释放完毕,柱塞会把针头拉回到胶囊中,最后整个胶囊会通过消化道排出体外。

(来源:Nature Biotechnology)
Giovanni Traverso 表示,L-SOMA 针对胃部设计开发,而非针对下消化道,胃内壁厚且肌肉发达,注射药物的同时也可以减轻有害副作用。
初现转化潜力,或可用于疫苗
为了评估药效,研究人员尝试使用该系统在动物试验中递送了四种常用注射药物,包括阿达木单抗、GLP-1 类似物、重组人胰岛素和肾上腺素,然后收集每只动物的血液样本进行比较。
在猪的临床前试验中,他们表示,该系统能够递送阿达木单抗 (Humira) 单抗,其药效与注射水平相似。这是一种用于治疗自身免疫性疾病的单抗,包括炎症性肠病、类风湿性关节炎、强直性脊柱炎等。他们还递送了一种称为 GLP-1 受体激动剂的蛋白质药物,该药用于治疗 2 型糖尿病。
“单抗口服给药是我们在药物递送领域面临的最大挑战之一,从工程的角度来看,深刻改变单抗递送方式能够变革我们治疗疾病的方法。”Giovanni Traverso 说。

图丨 Giovanni Traverso(来源:MIT)
连续数日给动物口服胶囊后,研究人员发现,这种药物递送方式可以保持一致,服用胶囊的动物胃内壁也没有出现注射受损的迹象。
都柏林大学资深药物递送教授 David Brayden 没有参与这项研究,他这样描述 L-SOMA:对于大分子口服给药,这种新方法是非常令人兴奋的一大进步。通过在大型动物进行试验,达到与注射这些类型药物相似的药效,这是该领域的一个技术里程碑。
现在,MIT 团队将与其合作者进一步探索 L-SOMA 的可能性,并推进该系统尽快进入临床。“通过基础工程应用,可口服的药物类型正在发生着改变,它改变了我们治疗不同疾病的思考方式。这种技术的进步还可以应用于需要定期给药的慢性病或偶发性疾病。如果可以口服给药,大量可注射药物的给药方式将会变得更容易。”Giovanni Traverso 说。
“今天我们认识到,口服药丸或者胶囊是首选的给药方式。无论是对患者还是对医疗保健提供方而言,更简单的服药方式会让患者更愿意服药,医疗保健提供方将更有可能采用更有效的疗法…… 我们团队正在开发让患者更容易服药的系统。”
研究人员预计,未来,患者有望口服多种此前只能注射的药物。同时,科学家认为 L-SOMA 也有潜力用于接种疫苗,包括新冠疫苗和其他疫苗。
他们表示,L-SOMA 可以递送多种大分子药物,能够为注射服用的药物提供一种新的递送思路,现已从动物试验中看到了该系统转化的潜力。不过,研究人员也承认还需要进行大量的临床试验评估 L-SOMA 的安全性和有效性。



















 鲁公网安备37020202000737号
鲁公网安备37020202000737号